|
深圳2023年7月10日 /美通社/ — 2023年7月10日,先健科技控股子公司元心科技(深圳)有限公司自主研發的創新產品 — IBS®可吸收藥物洗脫冠脈支架系統(以下簡稱「IBS®冠脈支架」)順利完成中國前瞻性、多中心、單組目標值臨床研究(即III期臨床研究)的全部受試者入組,標誌著先健科技在該全球首創產品的商業化道路上再次向前邁進重大步伐。
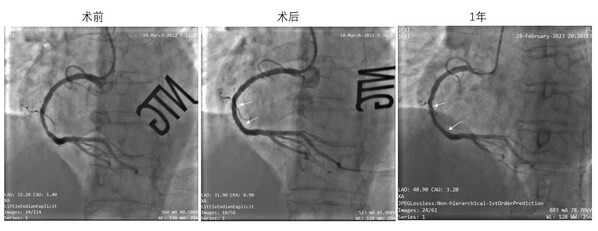
IBS®冠脈支架III期臨床研究是該產品中國確證性臨床研究的重要組成部分,於2023年2月正式啟動,歷時僅5個月,共計完成全部800餘名受試者入組。手術成功率為100%,截止目前無器械相關嚴重不良事件(SAE)發生。至此,該產品在中國的確證性臨床研究已完成全部受試者入組,全面進入臨床隨訪階段,將在達到主要研究終點後,提交上市註冊申請。
IBS®冠脈支架的中國確證性臨床研究於2021年8月獲批,根據國家藥品監督管理局藥品審評中心(CDE)發佈的指導原則,分為隨機對照研究(II期臨床研究)和單組目標值研究(III期臨床研究)兩個部分,旨在評估IBS®冠脈支架治療冠心病患者的安全性和有效性。IBS®冠脈支架的中國確證性臨床研究由高潤霖院士擔任主要研究者(PI),並邀請葛均波院士和韓雅玲院士,以及來自於全國近40家臨床研究中心的臨床專家傾力參與。此前,II期臨床研究歷時9個月順利完成全部518名受試者入組,手術成功率為100%,均已完成6個月隨訪,無器械相關嚴重不良事件(SAE)發生。
十七年潛心研發
全球首款全降解鐵基可吸收冠脈支架
冠心病是最常見的心血管疾病之一,發病率及死亡率高,嚴重威脅人類健康。近年來,中國及全球冠心病患者人數快速增長,我國目前冠心病患者人數已達1100萬人,心肌梗塞患者約為400-500萬人[1]。經皮冠狀動脈介入治療因其具備微創、省時、安全、高效等優勢從而發展迅速,現已成為冠心病治療的主流方式。然而,永久金屬冠脈支架因其不可降解,在植入人體後將會伴隨患者一生,使患者需要終生服藥、承擔遠期支架疲勞斷裂風險、血管再狹窄和動脈粥樣硬化發展二次干預受限等一系列問題。近年來,隨著醫學的不斷發展,「介入無植入」的血運重建已成為領域內的發展趨勢。
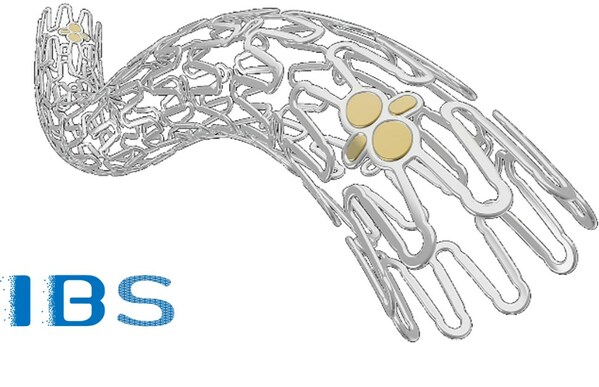
IBS®冠脈支架由先健科技歷經十七年自主研發,是全球首款全降解鐵基可吸收冠脈支架。其基體由高強度和高塑性的高純滲氮鐵管加工而成,支架壁薄(支架桿總壁厚僅為70μm)且支撐力強。創新的材料研究和獨特的技術路徑,使IBS®冠脈支架既保留了永久金屬冠脈支架規格齊全、物理性能優越、生物相容性好、操作簡單等優點,亦兼具完全可吸收的特性。其在完成對血管的有效支撐後(即植入3-6個月後)便開始降解,於2年左右安全進入降解尾聲,最終被人體組織所無害吸收,從而能夠有效避免植入永久金屬支架可能帶來的一系列遠期預後問題。
IBS®冠脈支架的可行性臨床研究(FIM,即I期臨床研究)於2018年開始受試者入組,目前已順利完成4年隨訪,結果表明其在簡單原發性冠脈病變中具有良好的中期安全有效性。血管造影(QCA)及血管內光學相幹成像(OCT)測量顯示,IBS®冠脈支架植入6個月後靶病變平均管腔面積略有增大的趨勢,說明IBS®冠脈支架逐漸降解後可能會對血管帶來正向重塑,從而有望真正體現「介入無植入」的理念和優勢。
前所未有 引領未來
IBS®冠脈支架III期臨床入組的順利完成將其中國確證性臨床研究推入下一個重要研究階段,是該創新產品、亦是先健科技鐵基生物可吸收材料平台發展上的又一個令人欣喜的重大里程碑。該項臨床研究的入組完成時間屬行業領先水平,這不僅體現了IBS®冠脈支架無可比擬的創新性帶來的濃厚學術研究氛圍,更體現了廣大專家對該產品為全球冠心病治療帶來革命性進步的殷切期盼和高度信心。
目前,IBS®冠脈支架已成功提交歐盟CE註冊申請,有望成為繼IBS Angel™鐵基可吸收支架系統之後,第二個在歐盟成功商業化的鐵基可吸收支架產品。隨著後續臨床研究和循證醫學的不斷完善,該革命性創新產品於全球市場的准入工作將進一步推進,在不久的將來為全球冠心病患者帶來前所未有的、安全有效的治療方式,並將積極推動相關疾病的治療全面邁入鐵基可吸收時代。
[1] 數據來源:CCIF 2021
關於先健科技:
先健科技公司(股份代號:1302.HK)是業內領先的心腦血管和外周血管介入醫療器械企業,於1999年成立於中國深圳,為國家級高新技術企業,國家工信部專精特新「小巨人」企業。公司在研、在售產品涵蓋結構性心臟病、外周血管病、起搏電生理、呼吸介入、神經介入、腫瘤介入等領域,並擁有全球首創的鐵基生物可吸收材料平台,在多個細分領域實現自主創新技術突破。截至2022年12月31日,公司已實現高質量專利佈局1,800餘項,目前累計15款產品獲國家藥品監督管理局(NMPA)批准進入「創新醫療器械特別審查程序」。 秉承「創新」和「國際化」發展戰略,公司主要在售產品的市場份額長期處於國內領先地位,並在全球6個國家擁有子公司和辦事處,銷售網絡覆蓋全球100多個國家和地區,是國內少有的業務具高度國際化的三類介入醫療器械企業。